Строй-Техника.ру
Строительные машины и оборудование, справочник
Активными веществами заряженного аккумулятора, участвующими в токообразующих процессах, являются: диоксид свинца на положительном электроде, губчатый свинец на отрицательном электроде и электролит — водный раствор серной кислоты. Серная кислота является сильным электролитом, т. е. раствор ее хорошо проводит электрический ток. Она частично диссоциирована на положительные и отрицательные ионы. Чем большее число ионов находится в растворе электролита, тем лучшим проводником он является.
Для объяснения процессов, протекающих при разряде и заряде свинцовых аккумуляторов, используем основные положения общепринятой теории двойной сульфатации. Название это означает, что при разряде на положительном и отрицательном электродах аккумулятора образуется один и тот же продукт — сульфат свинца. Физическая картина процессов, лежащих в основе этой теории, может быть кратко объяснена следующим образом. На отрицательном электроде свинец, частично растворяясь в электролите, выделяет в раствор положительные ионы. При этом на электроде остаются избыточные электроны, которые сообщают ему отрицательный заряд и движутся по внешнему участку замкнутой электрической цепи в направлении к положительному электроду.
Ионы двухвалентного свинца вступают в реакцию с сульфатными ионами серной кислоты, в результате чего образуется сернокислый свинец, который, обладая очень малой растворимостью в сернокислотном электролите, осаждается на поверхности отрицательного электрода. Таким образом, в процессе разряда активная масса отрицательного электрода превращается из губчатого свинца в сернокислый свинец.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
На положительном электроде потенциал образуется в результате перехода четырехвалентных ионов свинца из электролита на поверхность электрода. Диоксид свинца растворяется в электролите в очень малой степени, образует с водой химическое соединение — гидрат диоксида свинца, молекула которого в электролите распадается на четырехзарядный ион свинца и четыре однозарядных иона гидроксила.
Так как диоксид свинца обладает в растворе серной кислоты высоким положительным потенциалом, то он принимается в качестве положительной активной массы свинцовых аккумуляторов. Ионы четырехвалентного свинца переходят на поверхность электрода, сообщая ему положительный заряд, а отрицательные ионы гидроксила остаются в электролите. Таким образом, на границе между электродом и электролитом образуется двойной электрический слой. В этом случае электрод будет заряжен положительно, а прилегающий к нему слой электролита — отрицательно. Концентрация ионов четырехвалентного свинца также зависит от плотности электролита. Чем больше плотность электролита, тем выше потенциал электрода. При обычных плотностях электролита потенциал положительного электрода в заряженном состоянии равен примерно 1,68 В.
Если замкнуть внешнюю цепь, то под действием ЭДС аккумулятора в ней потечет электрический ток по направлению от положительного электрода к отрицательному. Электроны, накопившиеся на отрицательном электроде, будут перетекать по внешней цепи в противоположном направлении.
Каждые два электрона, поступившие с отрицательного электрода, будут восстанавливать положительный ион четырехвалентного свинца до двухвалентного иона свинца, который переходит в электролит и соединяется с ионом, образуя молекулу сульфата свинца. Сульфат свинца, обладая малой растворимостью, отлагается на поверхности положительного электрода в виде мелких кристаллов. Наряду с этим процессом происходит взаимодействие гидроксильных ионов, образовавшихся в результате распада гидроксила свинца на ионы, с четырьмя ионами водорода — продуктами диссоциации серной кислоты, в результате чего образуются четыре молекулы воды. Следовательно, на каждые две израсходованные молекулы серной кислоты и две молекулы воды образуется вновь четыре молекулы воды. Таким образом, плотность электролита в процессе разряда аккумулятора будет постоянно понижаться.
На отрицательном электроде по мере перетока электронов во внешнюю цепь происходит окисление свинца до двухвалентных ионов. Эти ионы свинца будут переходить в раствор серной кислоты — электролит и взаимодействовать с сульфат-ионами S04, образуя также сульфат свинца, который будет осаждаться на поверхности отрицательного электрода.
Схематическое изображение электродных процессов, протекающих при разряде свинцового аккумулятора, представлено на рис. 1, а.
Как видно из рассмотренных электродных процессов, при разряде аккумулятора в сульфат свинца переходят активные массы как положительного, так и отрицательного электродов, т. е. происходит двойная сульфатация.
Процессы при заряде аккумулятора. При заряде аккумулятора необходимо к его электродам присоединить источник тока, напряжение которого превышает ЭДС аккумулятора. При этом положительный полюс подключается к положительным электродам, а отрицательный полюс —к отрицательным электродам. Ток будет протекать через аккумулятор в направлении, обратном току разряда. Электроны будут перетекать с положительных на отрицательные электроды. Изменится также направление движения ионов в электролите. Ионы свинца будут переходить из электролита на электроды, а четырехвалентные ионы свинца — в электролит. Схематическое изображение основных электродных процессов, протекающих при заряде свинцового аккумулятора, представлено на рис. 1, б.
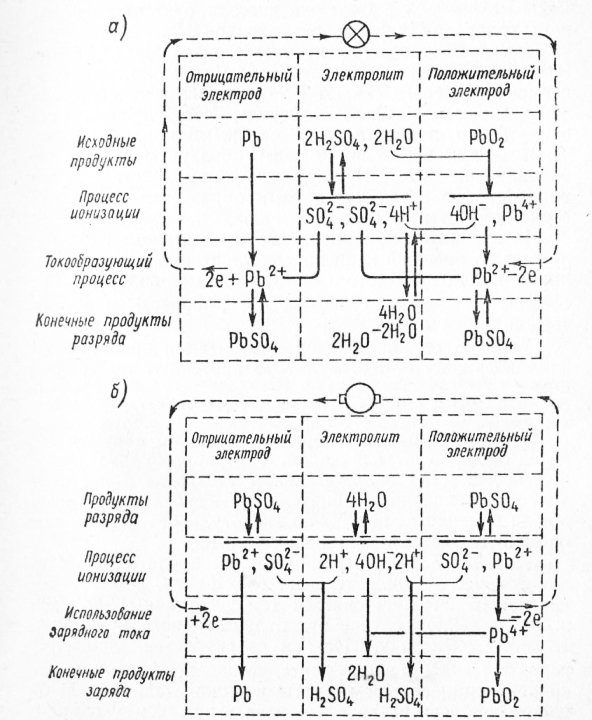
Рис. 1. Схема электрохимических процессов при разряде (а) и заряде (б) свинцового аккумулятора
При прохождении электрического тока ионы свинца на положительном электроде будут окисляться до четырехвалентного свинца, отдавая два электрона во внешнюю цепь. В свою очередь, ионы будут соединяться с четырьмя гидроксильными ионами, полученными при диссоциации воды, образуя молекулу диоксида свинца. В результате взаимодействия ионов водорода с сульфат-ионами образуется молекула серной кислоты.
На отрицательном электроде ионы свинца получают из внешней цепи по два электрона и восстанавливаются до губчатого свинца, а ионы водорода, соединяясь с ионами сульфата, образуют молекулу серной кислоты.
Таким образом, при заряде свинцового аккумулятора на обоих электродах происходит образование исходных веществ: на положительном электроде образуется диоксид свинца, на отрицательном — губчатый свинец, а вода заменяется на серную кислоту, в результате чего повышается концентрация электролита.
Повышение концентрации серной кислоты происходит больше у положительных электродов, чем у отрицательных. Это объясняется тем, что ионы движутся в данном случае от отрицательного к положительному электроду. Исходя из скоростей движения ионов электролите, установлено, что прирост концентрации серной кислоты у положительных электродов приблизительно в 1,4 раза выше, чем у отрицательных электродов. При разряде картина будет обратной. Поэтому, учитывая это обстоятельство, на практике принимают меры к улучшению циркуляции электролита v положительных электродов. Так, например, в автомобильных стартерных аккумуляторных батареях используют сепараторы, имеющие на стороне, обращенной к поверхности положительного электрода, специальные ребра для увеличения объема электролита у этого электрода. Плотность электролита повышается до тех пор, пока весь сульфат свинца не преобразуется в активные вещества. Прекращение повышения плотности электролита при заряде служит признаком окончания заряда аккумулятора. При дальнейшем заряде происходит разложение воды на водород и кислород, которые, выделяясь из электролита в виде газовых пузырьков, вызывают его кипение.
Рекламные предложения:
Главная → Справочник → Статьи → Форум
Механизация земляных работ
Механизация строительства
Механизация дорожных работ
Автоматизация строительства
→ Бетонные работы
→ Мини-тракторы
 Разделы
Разделы
Строительные машины и оборудование
→ Для специальных земляных работ
→ Дорожно-строительные машины
→ Строительное оборудование
→ Асфальтоукладчики и катки
→ Большегрузные машины
→ Строительные машины, часть 2,
→ Дорожные машины, часть 2
→ Ремонтные машины
→ Ковшовые машины
→ Автогрейдеры
→ Экскаваторы
→ Бульдозеры
→ Скреперы
→ Грейдеры
Эксплуатация строительных машин
→ Эксплуатация средств механизации
→ Эксплуатация погрузочных машин
→ Эксплуатация паровых машин
→ Эксплуатация экскаваторов
→ Эксплуатация подъемников
→ Эксплуатация кранов перегружателей
→ Эксплуатация кузовов машин
→ Крановщикам и стропальщикам
Ремонт строительных машин
Ремонт дорожных машин
Ремонт лесозаготовительных машин
Ремонт автомобилей КАмаЗ
Техническое обслуживание автомобилей
Очистка автомобилей при ремонте
Материалы и шины
Остались вопросы по теме:
"Токообразующие процессы"
— воспользуйтесь поиском.
→ Машины городского хозяйства
→ Естественная история машин
→ Транспортная психология
→ Пожарные автомобили
→ Автомобили-рефрижераторы
→ Монтаж и эксплуатация лифтов
→ Тракторы