Строй-Техника.ру
Строительные машины и оборудование, справочник
Главная задача лакокрасочных покрытий — защищать металлические изделия от коррозии. Коррозия наносит огромные убытки народному хозяйству. Подсчитано, что ежегодно разрушается около 1—2% общего количества черных металлов, находящихся в эксплуатации, т. е. в среднем во всем мире от коррозии ежегодно теряется 10—25 млн. т железа и чугуна.
Наряду с ущербом, наносимым коррозией в результате безвозвратной потери металла, велики также убытки, связанные с порчей и выходом из строя всевозможных машин и механизмов, приборов, металлических конструкций, в большинстве своем гораздо более ценных, чем металл, пошедший на их изготовление. Нередко в результате коррозии имеют место аварии.
Борьба с коррозией металлов приобрела особо важное значение и в связи с тем, что в настоящее время в машинах и аппаратах все большее распространение получают высокие температуры и давления, большие скорости, агрессивные среды, т. е. условия, благоприятствующие протеканию процесса коррозии.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Трудно указать область народного хозяйства, свободную от необходимости защиты металлов от коррозионных разрушений. Поэтому вполне понятно то исключительное внимание, которое уделяется в технике защите металлов от коррозии. Сохранить металл от разрушения — это значит «продлить жизнь» многим миллионам металлических изделий, машин, станков и всевозможных сооружений.
Коррозией называется процесс разрушения металла или сплава вследствие химических и электрохимических процессов. Не следует коррозию смешивать с эрозией — механическим разрушением поверхности. Так, например, истирание шейки вала — пример эрозии, ржавление этого же вала — пример коррозии.
Антикоррозийный, защитный эффект покрытия на органической основе зависит от свойств как пленко-образователя, так и пигмента: необходима химическая стойкость пленки к среде, ее нерастворимость в этой среде и хорошая прилипаемость к поверхности металла.
Коррозия может происходить и при наличии пленки в результате проникновения через нее агента, разрушающего металл.
Наиболее часто лаки и краски применяют для защиты металла от коррозии, возникающей под действием атмосферных факторов. Поэтому при сравнительном определении атмосферостойкости пленки и ее антикоррозийных свойств необходимо учитывать влияние климата, время года, положение экспонируемого образца, характер взятого металла, чистоту его поверхности, толщину пленки и т. д. В естественных условиях атмосферостойкость определяется лишь после длительной экспозиции, поэтому для выявления антикоррозийных свойств материала применяют ускоренные методы испытаний. В результате коррозии металлы переходят в соответствующие окислы или соли, т. е. в такое состояние, в котором они обычно находятся в природе. С этой точки зрения процесс коррозии можно рассматривать как процесс, противоположный получению металлов из руд.
По виду материала, из которого состоят защитные покрытия, различают: металлические, неметаллические (окисные, фосфатные, сульфатные, цементные и т. п.), неорганические и органические покрытия.
Наибольшее распространение в борьбе с коррозией металлов имеют неметаллические защитные покрытия. Для успешного их применения необходимо иметь представление о протекающих коррозийных процессах и методах защиты от коррозии.
Все покрытия независимо от способа получения материала классифицируются по характеру защитного действия. Покрытие может не только механически изолировать изделие от действия внешней среды, но также иметь в своем составе замедлители, или пассиваторы, которые усиливают защитные действия покрытия.
Для того чтобы понять механизм действия замедлителей, рассмотрим сущность электрохимической коррозии, которая дает объяснение большинства случаев коррозии.
Если с раствор соляной кислоты погрузить цинковую и медную пластинки и замкнуть их через гальванометр, то в цепи обнаружится наличие электрического тока. Гальванический элемент, как говорят, «будет работать».
В процессе работы такого элемента с цинковой пластинки в раствор будут переходить ионы цинка, и она будет растворяться, получая при этом отрицательный заряд. Пластинка меди останется неизменной и будет служить местом, где нейтрализуются катионы, т. е. положительно заряженные ионы раствора.
Процесс ионизации металла называется анодным процессом, а процесс разряда ионов — катодным процессом.
Электромеханическая коррозия, по существу, напоминает работу гальванических элементов, ибо любой металл не является однородным, а содержит различные включения, выполняющие функции электродов. При этом одни включения являются анодными участками, а другие— катодными. Анодные участки будут растворяться, а на катодных участках будет выделяться водород. Так, например, при погружении железной или стальной пластинки в соляную кислоту различные включения по отношению к металлу окажутся катодными участками, в то время как сам металл будет представлять анодные участки.
Процесс образования таких гальванических элементов можно представить схемой, изображенной на риc. 1. К анодным участкам будут двигаться ионы хлора, образуя здесь хлористое железо, а к катодным — ионы водорода. На катодных участках будет происходить разрядка ионов водорода и образование из атомов водорода молекул, которые частично в виде пузырьков газа выделяться из раствора.
Если к катоду не будет подводиться кислород, то в результате поглощения газа поверхностью твердого тела металл (катодные участки) будет насыщаться водородом. В результате катодные и анодные потенциалы уравняются и процесс растворения металла (коррозия) замедлится или совсем прекратится.
Растворение металла в кислоте можно рассматривать как результат работы колоссального количества микроскопических гальванических элементов, у которых катодами являются посторонние примеси, находящиеся в металле, а анодами — сам металл. Следует отметить, что коррозийное разрушение металлов вызывается не только наличием включений (примесей), создающих электрохимическую неоднородную поверхность, но также и неодинаковым строением металла, различием состава раствора у различных участков поверхности металла и другими факторами.
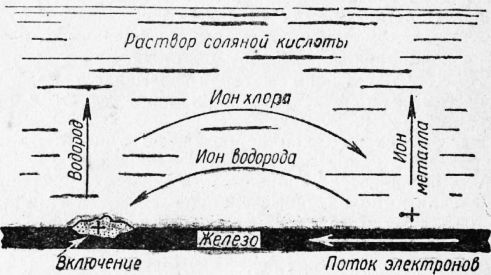
Рис. 1. Схема растворения железа (электрохимический процесс).
Металлические и лакокрасочные покрытия, содержащие в своем составе порошкообразные металлы, в зависимости от того, какой электродный потенциал они имеют по сравнению с защищаемым металлом, делятся на катодные и анодные. Анодные покрытия (например, цинковые, кадмиевые) защищают основной металл — железо не только путем изоляции его от влияния внешней среды, но и электрохимически, т. е. покрывающий металл будет играть роль анода, переходить в раствор и разрушаться, а основной металл станет катодом и тем самым будет предохраняться от коррозии.
Катодные покрытия могут защищать основной металл изделия только при условии достаточной сплошности. При наличии в катодном покрытии пор или трещин защищаемый металл на оголенных участках будет подвергаться сильной коррозии, так как эти участки будут являться анодом. Поэтому к катодным покрытиям предъявляются жесткие требования в отношении числа и размеров пор, получающихся при том или ином способе нанесения покрытия. К металлам, образующим катодные покрытия на железе, относят олово, медь, свинец, никель, хром и др.
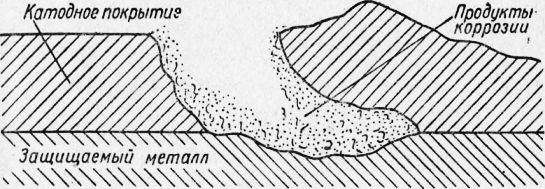
Рис. 2. Схема коррозии в поре катодного покрытия и отслаивания покрытия
Лакокрасочные покрытия вследствие их большой распространенности, доступности и дешевизны в противокоррозийной защите играют важную роль. На практике применяют комбинированные покрытия. Так, например, широко используют сочетания оксидных покрытий с лакокрасочными, металлических с лакокрасочными и т. д.
По характеру самого процесса коррозию разделяют на две основные группы: химическую и электрохимическую. Химическая коррозия протекает в неэлектролитах — жидкостях, не проводящих электрического тока, и в сухих газах при высоких температурах; электрохимическая коррозия — в электролитах и во влажных газах и характеризуется наличием двух параллельно идущих процессов: окислительного (растворение металлов) и восстановительного (выделение металла из раствора). Этот вид коррозии сопровождается протеканием электрического тока.
По характеру коррозийной среды различают следующие виды коррозии: газовую, атмосферную, жидкостную и почвенную.
Газовая коррозия происходит при отсутствии конденсации влаги на поверхности. На практике такой вид коррозии встречается при эксплуатации металлов при повышенных температурах.
Атмосферная коррозия относится к наиболее распространенному виду электрохимической коррозии, так как большинство металлических конструкций эксплуатируется в атмосферных условиях. Коррозия, протекающая в условиях любого влажного газа, также может быть отнесена к атмосферной коррозии.
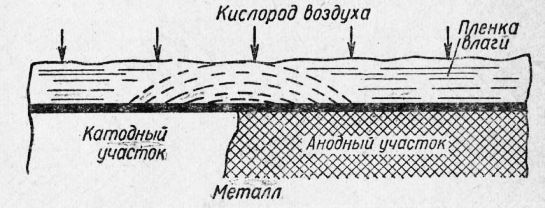
Рис. 3. Схема возникновения коррозии под пленкой влаги.
Жидкостная коррозия — весьма распространенный вид коррозии. В зависимости от того, в какой жидкой среде происходит коррозия, различают кислотную, щелочную, солевую, морскую и речную коррозии. По условиям воздействия жидкости на поверхность металла эти виды коррозии получают добавочные характеристики: с полным погружением, с переменным погружением, капельная, струевая. Кроме того, по характеру коррозийных разрушений различают: равномерную и неравномерную коррозию.
По внешнему виду коррозийное разрушение металла бывает весьма разнообразно. Если коррозийные разрушения концентрируются на определенных участках, то такой вид коррозии называется местной, или структурно-избирательной, коррозией.
Различают также коррозию пятнами, язвами, точками, межкристаллитную, внутрикристаллитную и подповерхностную. Межкристаллитная коррозия локализуется по границам кристаллов и при малом внешнем изменении приводит к значительной потере механической прочности металла. В отдельных случаях при такой коррозии металл может рассыпаться в порошок.
Подповерхностная коррозия начинается с поверхности, но распространяется под поверхностью металла.
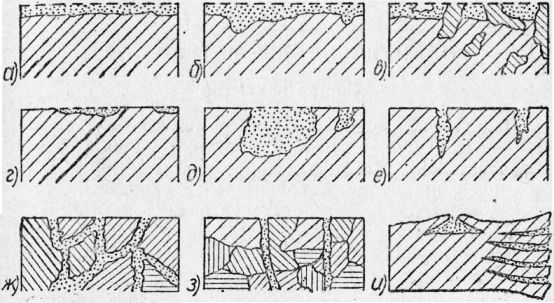
Рис. 4. Типы коррозийных разрушений:
а — равномерная; б — неравномерная; в — структурно-избирательная; г — пятнами; д — язвами; е—точками; ж — межкристаллитная; з — внутрикристаллитная; и — подповерхностная.
Этот вид коррозии вызывает вспучивание или расслаивание металла.
Рекламные предложения:
Главная → Справочник → Статьи → Форум
Механизация земляных работ
Механизация строительства
Механизация дорожных работ
Автоматизация строительства
→ Бетонные работы
→ Мини-тракторы
 Разделы
Разделы
Строительные машины и оборудование
→ Для специальных земляных работ
→ Дорожно-строительные машины
→ Строительное оборудование
→ Асфальтоукладчики и катки
→ Большегрузные машины
→ Строительные машины, часть 2,
→ Дорожные машины, часть 2
→ Ремонтные машины
→ Ковшовые машины
→ Автогрейдеры
→ Экскаваторы
→ Бульдозеры
→ Скреперы
→ Грейдеры
Эксплуатация строительных машин
→ Эксплуатация средств механизации
→ Эксплуатация погрузочных машин
→ Эксплуатация паровых машин
→ Эксплуатация экскаваторов
→ Эксплуатация подъемников
→ Эксплуатация кранов перегружателей
→ Эксплуатация кузовов машин
→ Крановщикам и стропальщикам
Ремонт строительных машин
Ремонт дорожных машин
Ремонт лесозаготовительных машин
Ремонт автомобилей КАмаЗ
Техническое обслуживание автомобилей
Очистка автомобилей при ремонте
Материалы и шины
Остались вопросы по теме:
"Главная задача лакокрасочных покрытий"
— воспользуйтесь поиском.
→ Машины городского хозяйства
→ Естественная история машин
→ Транспортная психология
→ Пожарные автомобили
→ Автомобили-рефрижераторы
→ Монтаж и эксплуатация лифтов
→ Тракторы